分子的极性是由分子中化学键的极性以及分子的几何结构共同决定的。判断分子极性大小的关键因素包括以下几点:
1. 化学键的极性: 分子中的化学键可以是极性的或非极性的。极性化学键是由电负性不同的原子形成的,如氧与氢的键。在极性化学键中,电子倾向于在电负性更高的原子周围积聚,形成局部正负电荷分离。非极性化学键则是由电负性相近的原子形成,如碳与氢的键,电子分布较均匀。
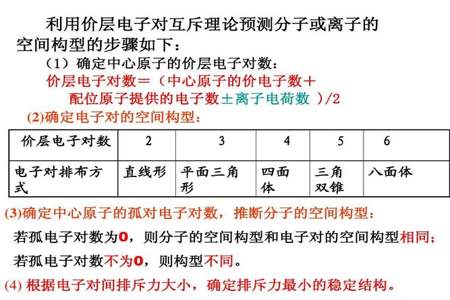
2. 分子的对称性: 分子的几何结构也影响极性。具有对称结构的分子通常极性较低,因为电荷分布在空间中更加均匀。而不对称结构的分子往往具有较高的极性,因为正负电荷分布不平衡。
3. 分子的整体几何形状: 分子的整体几何形状也影响极性。例如,如果分子呈线性排列,即原子排列在一条直线上,分子极性可能较低。如果分子呈现弯曲或扭曲结构,正负电荷分布会不均匀,从而增加分子的极性。
4. 分子中的部分电荷: 在分子中,极性化学键会导致分子中形成局部的正负电荷分布,即部分电荷。通过计算或实验测量这些部分电荷的大小,可以定量评估分子的极性大小。
总的来说,判断分子极性的大小需要考虑化学键的极性、分子的几何结构、整体形状以及部分电荷的分布情况。在分子中,这些因素相互作用,共同决定了分子的极性程度。
