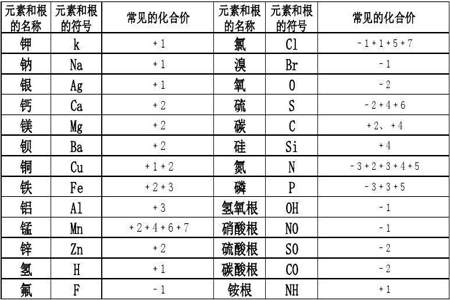
s 的化合价常见有-2,0,+4,+6
硫(Sulfur)是一种非金属元素,化学符号S,原子序数16,硫是氧族元素(ⅥA族)之一,在元素周期表中位于第三周期。
有关S的化合价
S(硫元素)的化合价取决于它与其他元素的结合方式。硫元素的常见化合价有:
-2:在H2S(氢硫酸)等分子中,硫与氢结合时呈现-2价。
+2:在SO2(二氧化硫)和SO3(三氧化硫)等分子中,硫与氧结合时呈现+2价。
+4:在H2SO4(硫酸)和Na2SO4(硫酸钠)等分子中,硫与氧结合时呈现+4价。
+6:在H2S2O3(硫代硫酸)等分子中,硫与氧结合时呈现+6价。
需要注意的是,硫元素有多种化合价,这是由于硫原子具有不同的电子排布和能级。在不同的化合物中,硫原子与其他原子结合时可能会呈现不同的化合价。在这些情况下,硫原子可以通过与不同数量的氧原子或氢原子结合,实现电子的偏移和化学键的形成。
有关S的化合价
化合价与元素的电子结构和化学反应有关。
对于元素S,其化合价可以是+2、+4或-2,具体取决于它所参与的化学反应和配位情况。
1. S的化合价为+2时,常见于硫化物(如硫化钠Na2S)中,其中硫原子与其他元素共享两个电子。
2. S的化合价为+4时,常见于硫的一氧化物(如二氧化硫SO2),硫原子在这种情况下与氧原子共享四个电子。
3. S的化合价为-2时,常见于硫化物离子(如硫化氢H2S),其中硫原子接受两个电子。
需要注意的是,这只是S的常见化合价,实际上它的化合价可能会随着不同的反应和配位环境而发生变化。
化合价的决定还需要考虑更多的化学知识和实际情况。
有关S的化合价
化合价是指一个元素在化合物中与其他元素结合时的价态,S的化合价有多种。
主要有+6,+4,+2和-2,具体取决于与它结合的元素及化合物的性质。
以硫酸为例,其中的硫原子的化合价为+6,而在硫化物中,硫原子的化合价则为-2。
此外,硫还能形成其他多种化合价的化合物,例如亚硫酸中的硫原子化合价为+4,二氧化硫中的硫原子化合价也为+4。
因此,S的化合价是多样的,取决于不同的化合物和化学反应。
